|
|
植物組織培養的原理是植物細胞具有全能性,取植物的部分組織或者單個細胞,在合適的培養基上經培育可以長成一株完整的植物。
植物細胞的全能性
植物細胞的全能性即是每個植物的本細胞或性細胞都具有該植物的全套遺傳基因,因此在一定培養條件下每個細胞都可發育成一個與母體一樣的植株。
植物組織培養的利用途徑
(一)增加遺傳變異性,改良作物
(二)繁殖植物
(三)有用化合物的工業化生産
(四)種質儲藏
植物組織培養
http://www.jlau.edu.cn/jiaowu/jpk/jpk/id6_xxzd_33.asp
植物組織培養是把植物的器官,組織以至單個細胞,應用無菌操作使其在人工條件下,能夠繼續生長,甚至分化發育成一完整植株的過程。植物的組織在培養條件下,原來已經分化停止生長的細胞,又能重新分裂,形成沒有組織結構的細胞團,即愈傷組織。這一過程稱為“脫分化作用”,已經“脫分化”的愈傷組織,在一定條件下,又能重新分化形成輸導係統以及根和芽等組織和器官,這一過程稱“再分化作用”。植物激素在此過程中起着重要的作用,吲哚乙酸( iaa )和 6 ╟苄基氨基腺嘌呤( 6 ╟ ba )的比例,决定了根和芽的分化。
近年來,組織培養作為一種研究技術,已廣泛地應用於許多學科中,它不僅對理論研究有重要意義,並已展現了十分廣阔的應用前景。
一、原理
植物組織經過脫分化作用,形成愈傷組織,經過再分化作用,愈傷組織又能重新分化為有結構的組織和器官,最終形成完整的植株。早在 1957 年 skoog 即發現培養基中植物激素的類型和它們的比例,對再分化過程起着重要的作用。
二、試劑與儀器設備
(一)試劑
•乙醇。
•iaa 或 2 , 4 ╟ d 。
•hgcl 2 (或次氯酸鈉)。
•6- 苄基氨基腺嘌呤( 6-ba )
•ms 培養基(見附錄)。
(二)儀器設備
培養室,高壓滅菌鍋,水浴鍋,解剖刀,三角燒瓶( 100ml ),燒杯,量筒,培養皿,棉綫,接種箱或超淨工作臺,分析天平,長鑷子,剪刀,容量瓶,移液管,牛皮紙。
三、實驗步驟
1. 配製培養基
( 1 )愈傷組織誘導培養基: ms 培養基(蔗糖含量為 10 g/l , 2,4 ╟ d 含量為 2 mg/l ,瓊脂 10 g/l )。
( 2 )試驗培養基:在 ms 培養基中按表 33 ╟ 1 加入 iaa 和 6╟ba 。
吲哚乙酸先用少量 0.1 mol/l naoh 溶解, 6- 苄基氨基腺嘌呤先用少量 0.1 mol/l hcl 溶解,然後用蒸餾水稀釋,再加入培養基中。
33 ╟ 1 試驗培養基中 iaa 和 6 ╟ ba 含量
序號
iaa ( mg/l )
6-ba ( mg/l )
相對比值
1
0
2.0
2
0.2
2.0
1:10
3
0.5
2.0
1:4
4
1.0
2.0
1:2
5
2.0
2.0
1:1
6
2.0
1.0
2:1
7
2.0
0.5
4:1
8
2.0
0.2
10:1
9
2.0
0
2. 培養基滅菌
將配好的培養基加入瓊脂加熱溶解,調至 ph 5.8 ,趁熱分裝於 100 ml 三角燒瓶中,每瓶約 20 ml 。待培養基冷卻凝固後,用一層稱量紙和一層牛皮紙包紮瓶(管)口,並用棉綫紮牢,然後在高壓滅菌鍋中 121 ℃( 1 kg/cm 2 )下滅菌 20 min 。取出三角燒瓶放在臺子上,冷卻後備用。接種操作所需的一切用具(如長鑷子、解剖刀、剪刀等)及滅菌水,需同時滅菌。
3. 誘導産生愈傷組織
( 1 )取健壯的煙草莖數段,每段約 5 cm 長,於燒杯中用 0.1% 氯化汞(升汞)浸泡 20 min ,取出用無菌水洗 3 ~ 4 次,置於無菌培養皿中,在接種箱中按無菌操作要求剝去外皮(接種箱事先用紫外燈滅菌 30 min ),用解剖刀切成 5 mm 厚的圓片(棄去開始一片和最後一片),用長鑷子將它接種在誘導培養基上,註意圓片的切口朝嚮培養基,每瓶接種 4 片,接種後紮好瓶口。
( 2 )將已接入植物組織(外植體)的三角燒瓶,培養在 25 ℃溫室中,每星期檢查 l ~ 2 次,剔除材料已被雜菌污染的三角燒瓶, 3 ~ 4 周後産生愈傷組織。
( 3 )選取愈傷組織生長良好的三角燒瓶,用解剖刀將愈傷組織切下,轉移到含有不同激素的試驗培養基中(也可以連同原來的外植體一起轉移),每瓶放 1 ~ 2 塊,仍培養在 25 ℃溫室中,每周 1 ~ 2 次觀察不同處理的三角燒瓶中,愈傷組織分化情況,直至長出根和芽。長成的幼小植株即為“試管苗”,可移栽於花盆中。
植物組織培養發展簡史植物組織培養是20世紀30年代初期發展起來的一項生物技術。它是在人工配製的培養基上,於無菌狀態下培養植物器官、組織、細胞、原生質體等材料的方法。
植物細胞的全能性是植物組織培養的理論基礎。20世紀初,曾有人提出能否將植物的薄壁細胞培養成完整植株?研究者從鬍蘿蔔根的韌皮部取下一塊組織,並在液體培養基中培養,使其分化出了愈傷組織,從愈傷組織又得到胚狀體,胚狀體轉移到固體培養基上繼續培養後,獲得了完整的鬍蘿蔔試管植株。經過栽培,此植株能夠正常生長並開花結果,其種子繁衍出來的後代與正常植株的種子所繁衍出的後代別無二緻。根據此實驗可以得出以下結論:即不經過有性生殖過程也能將植物的薄壁細胞培養出與母體一樣的完整植株。由於植物的每個有核細胞都攜帶着母體的全部基因,故在一定條件下,它們均能發育成完整植株,這就是所謂的植物細胞全能性。
科學家在植物激素對器官建成,及改進培養基配方等方面所取得的成果,極大地推動了組織培養技術的發展,使這項技術可以實際應用於快速繁殖、品種改良等方面。20世紀50年代初期,法國科學家利用組織培養技術成功地脫除了染病大麗花植株所攜帶的病毒,從而為脫毒苗的生産提供了一種可行的途徑。現在憑藉組織培養技術來脫除植物的病毒已經在生産中廣泛應用。20世紀50年代中期,由於細胞分裂素的發現,使組織培養狀態下外植體芽的形態建成成為可人為調控的因素,從而使在組織培養狀況下進行植株再生成為現實。進入60年代以後,組織培養技術在基礎理論、實際操作方面不斷取得進展,相繼在植物體細胞雜交、單倍體育種、種質資源保存、快速育苗、人工種子製造、次生代謝物生産等方面有了可喜的成果。時至今日,組織培養技術已經成為基礎堅實、易於掌握、應用面廣的一種技術手段。
愈傷組織及其形成愈傷組織(callus)原指植物體的局部受到創傷刺激後,在傷口表面新生的組織。它由活的薄壁細胞組成,可起源於植物體任何器官內各種組織的活細胞。在植物體的創傷部分,愈傷組織可幫助傷口愈合;在嫁接中,可促使砧木與接穗愈合,並由新生的維管組織使砧木和接穗溝通;在扦插中,從傷口愈傷組織可分化出不定根或不定芽,進而形成完整植株。在植物器官、組織、細胞離體培養時,條件適宜也可以長出愈傷組織。其發生過程是:外植體中的活細胞經誘導,恢復其潛在的全能性,轉變為分生細胞,繼而其衍生的細胞分化為薄壁組織而形成愈傷組織。從植物器官、組織、細胞離體培養所産生的愈傷組織,在一定條件下可進一步誘導器官再生或胚狀體而形成植株。在單倍體育種中,也可由花粉産生的愈傷組織或胚狀體分化成單倍體植株。甚至可由原生質體培養誘導植株或器官再生。故愈傷組織的概念已不局限於植物體創傷部分的新生組織了。
在植物的組織培養中,從一塊外植體形成典型的愈傷組織,大致要經歷三個時期:啓動期、分裂期和形成期。啓動期指細胞準備進行分裂的時期。外源植物生長激素對誘導細胞開始分裂效果很好。常用的有萘乙酸、吲哚乙酸、細胞分裂素等。通常使用細胞分裂素和生長素比例在1∶1來誘導植物材料愈傷組織的形成,如ms+6-ba6-ba是一種人工合成的細胞分裂素6基腺嘌呤的簡稱。0.5 mg/l+ibaiba是一種人工合成的生長素吲哚丁酸的簡稱。0.5 mg/l。分裂期是指外植體細胞經過誘導以後脫分化,不斷分裂、增生子細胞的過程。分裂期愈傷組織的特點是:細胞分裂快,結構疏鬆,顔色淺而透明。分化期是指在分裂的末期,細胞內開始出現一係列形態和生理上的變化,從而使愈傷組織內産生不同形態和功能的細胞。這些細胞類型有薄壁細胞、分生細胞、色素細胞、纖維細胞等等。外植體的細胞經過啓動、分裂和分化等一係列變化,形成了無序結構的愈傷組織。如果在原來的培養基上繼續培養愈傷組織,會由於培養基中營養不足或有毒代謝物的積纍,導致愈傷組織停止生長,甚至老化變黑、死亡。如果要讓愈傷組織繼續生長增殖,必須定期地(2~4個星期)將它們分成小塊,接種到新鮮的培養基上,這樣愈傷組織就可以長期保持旺盛的生長。
愈傷組織的形態發生方式經過啓動、分裂和分化期産生的愈傷組織,其中雖然發生了細胞分化,但並沒有器官發生。衹有滿足某些條件,愈傷組織的細胞纔會發生再分化,産生芽和根,進而發育成完整植株。組織培養中誘導叢芽産生一般使用較高的細胞分裂素和較低的生長素配比,如ms+6-ba1 mg/l+iaa(iaa是一種生長素3-吲哚乙酸的簡稱。)0.1 mg/l。而誘導生根時則可采用1/2ms+iaa0.1 mg/l等。當然,不同的植物種類、不同的生長狀態,激素的配比會有很大變化,這需要在實踐中摸索,取得經驗。 |
|
植物組織培養的原理是植物細胞具有全能性,取植物的部分組織或者單個細胞,在合適的培養基上經培育可以長成一株完整的植物。
植物細胞的全能性
植物細胞的全能性即是每個植物的本細胞或性細胞都具有該植物的全套遺傳基因,因此在一定培養條件下每個細胞都可發育成一個與母體一樣的植株。
植物組織培養的利用途徑
(一)增加遺傳變異性,改良作物
(二)繁殖植物
(三)有用化合物的工業化生産
(四)種質儲藏
植物組織培養
http://www.jlau.edu.cn/jiaowu/jpk/jpk/id6_xxzd_33.asp
植物組織培養是把植物的器官,組織以至單個細胞,應用無菌操作使其在人工條件下,能夠繼續生長,甚至分化發育成一完整植株的過程。植物的組織在培養條件下,原來已經分化停止生長的細胞,又能重新分裂,形成沒有組織結構的細胞團,即愈傷組織。這一過程稱為“脫分化作用”,已經“脫分化”的愈傷組織,在一定條件下,又能重新分化形成輸導係統以及根和芽等組織和器官,這一過程稱“再分化作用”。植物激素在此過程中起着重要的作用,吲哚乙酸( iaa )和 6 ╟苄基氨基腺嘌呤( 6 ╟ ba )的比例,决定了根和芽的分化。
近年來,組織培養作為一種研究技術,已廣泛地應用於許多學科中,它不僅對理論研究有重要意義,並已展現了十分廣阔的應用前景。
一、原理
植物組織經過脫分化作用,形成愈傷組織,經過再分化作用,愈傷組織又能重新分化為有結構的組織和器官,最終形成完整的植株。早在 1957 年 skoog 即發現培養基中植物激素的類型和它們的比例,對再分化過程起着重要的作用。
二、試劑與儀器設備
(一)試劑
•乙醇。
•iaa 或 2 , 4 ╟ d 。
•hgcl 2 (或次氯酸鈉)。
•6- 苄基氨基腺嘌呤( 6-ba )
•ms 培養基(見附錄)。
(二)儀器設備
培養室,高壓滅菌鍋,水浴鍋,解剖刀,三角燒瓶( 100ml ),燒杯,量筒,培養皿,棉綫,接種箱或超淨工作臺,分析天平,長鑷子,剪刀,容量瓶,移液管,牛皮紙。
三、實驗步驟
1. 配製培養基
( 1 )愈傷組織誘導培養基: ms 培養基(蔗糖含量為 10 g/l , 2,4 ╟ d 含量為 2 mg/l ,瓊脂 10 g/l )。
( 2 )試驗培養基:在 ms 培養基中按表 33 ╟ 1 加入 iaa 和 6╟ba 。
吲哚乙酸先用少量 0.1 mol/l naoh 溶解, 6- 苄基氨基腺嘌呤先用少量 0.1 mol/l hcl 溶解,然後用蒸餾水稀釋,再加入培養基中。
33 ╟ 1 試驗培養基中 iaa 和 6 ╟ ba 含量
序號
iaa ( mg/l )
6-ba ( mg/l )
相對比值
1
0
2.0
2
0.2
2.0
1:10
3
0.5
2.0
1:4
4
1.0
2.0
1:2
5
2.0
2.0
1:1
6
2.0
1.0
2:1
7
2.0
0.5
4:1
8
2.0
0.2
10:1
9
2.0
0
2. 培養基滅菌
將配好的培養基加入瓊脂加熱溶解,調至 ph 5.8 ,趁熱分裝於 100 ml 三角燒瓶中,每瓶約 20 ml 。待培養基冷卻凝固後,用一層稱量紙和一層牛皮紙包紮瓶(管)口,並用棉綫紮牢,然後在高壓滅菌鍋中 121 ℃( 1 kg/cm 2 )下滅菌 20 min 。取出三角燒瓶放在臺子上,冷卻後備用。接種操作所需的一切用具(如長鑷子、解剖刀、剪刀等)及滅菌水,需同時滅菌。
3. 誘導産生愈傷組織
( 1 )取健壯的煙草莖數段,每段約 5 cm 長,於燒杯中用 0.1% 氯化汞(升汞)浸泡 20 min ,取出用無菌水洗 3 ~ 4 次,置於無菌培養皿中,在接種箱中按無菌操作要求剝去外皮(接種箱事先用紫外燈滅菌 30 min ),用解剖刀切成 5 mm 厚的圓片(棄去開始一片和最後一片),用長鑷子將它接種在誘導培養基上,註意圓片的切口朝嚮培養基,每瓶接種 4 片,接種後紮好瓶口。
( 2 )將已接入植物組織(外植體)的三角燒瓶,培養在 25 ℃溫室中,每星期檢查 l ~ 2 次,剔除材料已被雜菌污染的三角燒瓶, 3 ~ 4 周後産生愈傷組織。
( 3 )選取愈傷組織生長良好的三角燒瓶,用解剖刀將愈傷組織切下,轉移到含有不同激素的試驗培養基中(也可以連同原來的外植體一起轉移),每瓶放 1 ~ 2 塊,仍培養在 25 ℃溫室中,每周 1 ~ 2 次觀察不同處理的三角燒瓶中,愈傷組織分化情況,直至長出根和芽。長成的幼小植株即為“試管苗”,可移栽於花盆中。
植物組織培養發展簡史植物組織培養是20世紀30年代初期發展起來的一項生物技術。它是在人工配製的培養基上,於無菌狀態下培養植物器官、組織、細胞、原生質體等材料的方法。
植物細胞的全能性是植物組織培養的理論基礎。20世紀初,曾有人提出能否將植物的薄壁細胞培養成完整植株?研究者從鬍蘿蔔根的韌皮部取下一塊組織,並在液體培養基中培養,使其分化出了愈傷組織,從愈傷組織又得到胚狀體,胚狀體轉移到固體培養基上繼續培養後,獲得了完整的鬍蘿蔔試管植株。經過栽培,此植株能夠正常生長並開花結果,其種子繁衍出來的後代與正常植株的種子所繁衍出的後代別無二緻。根據此實驗可以得出以下結論:即不經過有性生殖過程也能將植物的薄壁細胞培養出與母體一樣的完整植株。由於植物的每個有核細胞都攜帶着母體的全部基因,故在一定條件下,它們均能發育成完整植株,這就是所謂的植物細胞全能性。
科學家在植物激素對器官建成,及改進培養基配方等方面所取得的成果,極大地推動了組織培養技術的發展,使這項技術可以實際應用於快速繁殖、品種改良等方面。20世紀50年代初期,法國科學家利用組織培養技術成功地脫除了染病大麗花植株所攜帶的病毒,從而為脫毒苗的生産提供了一種可行的途徑。現在憑藉組織培養技術來脫除植物的病毒已經在生産中廣泛應用。20世紀50年代中期,由於細胞分裂素的發現,使組織培養狀態下外植體芽的形態建成成為可人為調控的因素,從而使在組織培養狀況下進行植株再生成為現實。進入60年代以後,組織培養技術在基礎理論、實際操作方面不斷取得進展,相繼在植物體細胞雜交、單倍體育種、種質資源保存、快速育苗、人工種子製造、次生代謝物生産等方面有了可喜的成果。時至今日,組織培養技術已經成為基礎堅實、易於掌握、應用面廣的一種技術手段。
愈傷組織及其形成 愈傷組織(callus)原指植物體的局部受到創傷刺激後,在傷口表面新生的組織。它由活的薄壁細胞組成,可起源於植物體任何器官內各種組織的活細胞。在植物體的創傷部分,愈傷組織可幫助傷口愈合;在嫁接中,可促使砧木與接穗愈合,並由新生的維管組織使砧木和接穗溝通;在扦插中,從傷口愈傷組織可分化出不定根或不定芽,進而形成完整植株。在植物器官、組織、細胞離體培養時,條件適宜也可以長出愈傷組織。其發生過程是:外植體中的活細胞經誘導,恢復其潛在的全能性,轉變為分生細胞,繼而其衍生的細胞分化為薄壁組織而形成愈傷組織。從植物器官、組織、細胞離體培養所産生的愈傷組織,在一定條件下可進一步誘導器官再生或胚狀體而形成植株。在單倍體育種中,也可由花粉産生的愈傷組織或胚狀體分化成單倍體植株。甚至可由原生質體培養誘導植株或器官再生。故愈傷組織的概念已不局限於植物體創傷部分的新生組織了。
在植物的組織培養中,從一塊外植體形成典型的愈傷組織,大致要經歷三個時期:啓動期、分裂期和形成期。啓動期指細胞準備進行分裂的時期。外源植物生長激素對誘導細胞開始分裂效果很好。常用的有萘乙酸、吲哚乙酸、細胞分裂素等。通常使用細胞分裂素和生長素比例在1∶1來誘導植物材料愈傷組織的形成,如ms+6-ba6-ba是一種人工合成的細胞分裂素6基腺嘌呤的簡稱。0.5 mg/l+ibaiba是一種人工合成的生長素吲哚丁酸的簡稱。0.5 mg/l。分裂期是指外植體細胞經過誘導以後脫分化,不斷分裂、增生子細胞的過程。分裂期愈傷組織的特點是:細胞分裂快,結構疏鬆,顔色淺而透明。分化期是指在分裂的末期,細胞內開始出現一係列形態和生理上的變化,從而使愈傷組織內産生不同形態和功能的細胞。這些細胞類型有薄壁細胞、分生細胞、色素細胞、纖維細胞等等。外植體的細胞經過啓動、分裂和分化等一係列變化,形成了無序結構的愈傷組織。如果在原來的培養基上繼續培養愈傷組織,會由於培養基中營養不足或有毒代謝物的積纍,導致愈傷組織停止生長,甚至老化變黑、死亡。如果要讓愈傷組織繼續生長增殖,必須定期地(2~4個星期)將它們分成小塊,接種到新鮮的培養基上,這樣愈傷組織就可以長期保持旺盛的生長。
愈傷組織的形態發生方式經過啓動、分裂和分化期産生的愈傷組織,其中雖然發生了細胞分化,但並沒有器官發生。衹有滿足某些條件,愈傷組織的細胞纔會發生再分化,産生芽和根,進而發育成完整植株。組織培養中誘導叢芽産生一般使用較高的細胞分裂素和較低的生長素配比,如ms+6-ba1 mg/l+iaa(iaa是一種生長素3-吲哚乙酸的簡稱。)0.1 mg/l。而誘導生根時則可采用1/2ms+iaa0.1 mg/l等。當然,不同的植物種類、不同的生長狀態,激素的配比會有很大變化,這需要在實踐中摸索,取得經驗。 |
植物組織培養的概念 The concept of plant tissue culture |
 植物组织培养的概念 植物组织培养的概念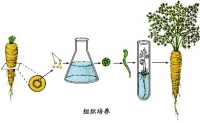 植物组织培养的概念 植物组织培养的概念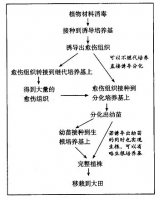 植物组织培养的概念 植物组织培养的概念 |
植物組培發展簡史 Brief History of Plant Tissue Culture |
 组织培养 植物组培发展简史 组织培养 植物组培发展简史
1839年Schwann提出細胞有機體的每一個生活細胞在適宜的外部環境條件下都有獨立發育的潛能。1853年trecul利用離體的莖段和根段進行培養獲得了愈傷組織,愈傷組織是指一種沒有器官分化但能進行活躍分裂的細胞團,但這還不能證明細胞具有全能性,因為由愈傷組織沒能再生出完整植物體。1901年Morgan首次提出一個全能性細胞應具有發育出一個完整植株的能力。所謂全能性細胞就是指具有完整的膜係統和細胞核的生活細胞,在適宜的條件下可通過細胞分裂與分化,再生出一個完整植株。White指出:如果一個給定的有機體的所有細胞都大致相同,並具有全能性,那麽在有機體內所觀察到的細胞分化必定是這些細胞對有機體內微環境和周圍環境的反應。就是說機體內每個細胞所以沒有表現出全能性,是因為該細胞所處位置的不同,致使其某些功能被抑製(suppressed),着充分說明機體內的微環境因素在細胞分化中起了十分重要的作用。按照現代發育生物學和細胞生物學的理論,細胞分化是受基因在時間和空間兩個方面的調空,空間就是指細胞在機體內所處的位置。不同位置的細胞,其基因的表達不同,細胞所表現出的形態結構和行為就不同。如果將一個生活的細胞從植物體內分離出來,使之脫離開原有的環境,細胞被抑製的功能將有望得以恢復,重新表現出全能性。基於這種認識,科學工作者便萌生出了植物組織培養的念頭。
Haberlandt(1902)首次提出細胞培養的概念,也是第一個用人工培養基對分離的植物細胞進行培養的人。與rechinger不同,Haberlandt相信切塊大小不會影響細胞增殖,但由於Haberlandt使用的培養液成分簡單,培養的細胞是高度分化的細胞,又沒采取消毒技術,所以實驗失敗,培養的細胞雖然存活了幾個月但沒能分裂。Haberlandt轉而對損傷修復發生興趣,提出激素作用的概念(leptohormone),與維管組織特別是韌皮部有關;另一類是創傷激素(woundhomone),與細胞損傷有關,為後來激素理論的建立和在組織培養中的廣泛應用奠定了基礎。但自Haberlandt的實驗之後直到1934年White培養番茄離體根尖的成功,其間的30多年裏,植物組織培養技術幾乎沒有什麽進展。分析其原因,主要就是培養基的成分和實驗所選取的材料不夠合適。
1934年White用離體的番茄根建立了第一個活躍生長的無性係,使根的離體培養實驗首次獲得了真正的成功,並首次發現和提出B族維生素B1、維生素B6和煙酸的重要性。與此同時,Cautheret在山毛柳和黑楊形成層組織的培養中也發現了B族維生素的作用,並使培養獲得了成功。Nobecourt也用鬍蘿蔔建立了類似的連續生長的組織培養物。因此,Haberlandt、White和Nobecourt一起被譽為植物組織培養的奠基人。人們現在所用的若幹培養方法和培養基,原則上都是他們在1939年所建立的方法和培養基演變的結果,幾乎所有的培養基中都添加了不同種類和不同數量的B族維生素。從此植物組織培養進入快速發展時期。1941年,Overbeek、Conklin和Blakeslee等用附加椰乳到培養基中,獲得了Datura離體胚培養的成功。椰乳成分復雜,含有多種不同的有機物,後來的研究發現,其中在組織培養中起主要作用的是腺嘌呤類激素或類似物。1944年,Skoog報道DNA的降解産物腺嘌呤和腺苷可以促進愈傷組織的生長,解除生長素對芽形成的抑製作用,誘導芽的形成。1948年,Caplin和Steward用實驗證明椰乳與2,4-D配合,對培養的鬍蘿蔔和馬鈴薯組織的增殖起到明顯的促進作用。在用煙草髓細胞誘導愈傷組織的實驗中,Skoog,Miller等分離確定了6-呋喃氨基嘌呤對細胞分裂有促進作用,並命名為“激動素”(Kinetin)。之後,與此相關的同係物6-苄氨基嘌呤被合成,它也刺激培養物的細胞分裂。於是,出現了“細胞分裂素”這一集合名詞,專門用來指能刺激培養物細胞分裂的一組6-某基團的氨基嘌呤化合物。爾後,玉米素、異戊烯基腺嘌呤和其他細胞分裂素等植物激素的相繼發現,更增加了細胞分裂素的種類。由於發現生長素和細胞分裂素相互配合能調節細胞的分裂與分化,控製器官的分化,生長素高時可誘導根的形成,細胞分裂素高時可促進芽的分化,使植物組織培養的工作迅速取得突破。1958年美國的Steward和德國的Reinert分別由培養的鬍蘿蔔細胞誘導形成了胚狀體,1965年由Vasil和Hildebrandt用單個分離的細胞培養獲得整個植株的再生,從而使植物細胞全能性的理論真正得到了科學的證實。從此之後,一批又一批植物的組織或器官通過培養的方法獲得了再生植株。
20世紀60年代,在植物組織培養方面的另外兩項成就就是劃分小孢子培養和原生質體培養的成功。Guha和Maheshwari(1966,1967),Rourgin和Nitsch(1967)先後利用煙草和鬍蘿蔔的小孢子培養獲得單倍體植株,並成功地實現了染色體的加倍,使這種同源二倍體植株在5個月內收穫到種子。Cocking等用純化的纖維素酶和果膠酶處理煙草細胞,獲得原生質體,通過調節滲透壓的方法控製原生質體膨脹,使培養獲得成功,得到了再生植株。自20世紀60年代始,植物組織與細胞培養逐漸走嚮了工廠化和商品化階段。
現在已不能確切統計有多少種植物通過組織培養的方法獲得了再生植株,因為幾乎每天都有可能出現利用新的植物種類獲得培養成功的報道。植物組織培養已經變成了一種常規的實驗技術,廣泛應用於植物的脫毒、快繁、基因工程、細胞工程、遺傳研究、次生代謝物質的生産、工廠化育苗等多個方面;從高級的研究機構、大專院校到普通的生物技術公司,甚至農民專業戶都在不同程度的利用或開展組織培養工作。
植物組織培養已經走過了近百年的歷程。它的歷史不僅證明了植物的每一個生活細胞都含有一種植物的全部遺傳信息,在一定的條件下可以發育成一個完整的植株,而且在一定範圍內人們可以按照意願,改變和調節植物的發育。但這種調節和改變知識局部的,主要是通過改變培養基中的激素和培養條件,從遺傳基礎上的徹底改造僅僅是開始。但是,生命的奧秘是很深遠的,植物也如此,科學家至今仍不能實現對所有植物的組織培養再生,對基因型對組培成功的影響至今仍迷惑不解,而且對已經獲得成功的植物,也還是有很多問題沒有解决。即便像煙草和擬南芥這樣的模式植物,也沒能實現讓它們在組培容器中遂願的生長發育和開花結實。人們對植物的認識、瞭解和掌握,仍然處於必然王國階段,單就其組織培養而言,還有十分漫長的道路要走。 |
植物組培的應用前景 The application prospects of plant tissue culture |
1、快速繁殖某些稀有植物或有較大經濟價值的植物 依靠自然條件在較短時間內繁殖稀有植物和經濟價值較高的植物,受到地理環境和季節的限製,很難達到快速、高效的目的;特別對於在短時期內需要達到一定數量,才能創造應有價值的植物,時間就是效益,衹有通過組織培養的方法才能滿足這一要求。
用組織培養法繁殖植物,這是組織培養應用於生産的主要的和成效最大的實例。首先是在蘭花上的成功應用。自Morel在1960年得到蘭花組織培養苗後,很快應用於生産,形成了組織培養法繁殖蘭花工業。
由於組織培養法繁殖植物的明顯特點是快速,每年可以數以百完倍速度繁殖,因此對一些繁殖係數低,不能用種子繁殖的名特優植物品種的繁殖,尤為意義重大。 2、脫毒 植物中有很多都帶有病毒,嚴重影響植物的産量和品質,給農業帶來災害。特別是無性繁殖植物,如馬鈴薯、草莓、大蒜、康乃馨等,由於病毒是通過維管束傳導的,因此利用這些植物營養器官繁殖,就會把病毒帶到新的植物個體上而發生病害。但是也證明感病植株並不是每個部位都帶有病毒,如莖尖生長點尚未分化成維管束的部分,可能不帶病毒。若利用組織培養法進行莖尖培養,再生的植株有可能不帶病毒,從而獲得脫病毒的苗,再用這種苗進行繁殖,則種植的植物就不會或極少發生病毒病。
所獲得的脫毒苗一定要經過鑒定,確認不帶病毒才能使用。使用組織培養法獲得脫毒苗已經在草莓、葡萄、康乃馨等獲得成功,産生明顯的經濟效應。 3、植物種質資源的保存、輓救瀕於滅絶的植物 長期以來人們想了很多方法來保存植物,如儲存果實,儲存種子,儲存塊根、塊莖、種球、鱗莖;用常溫、低溫、變溫、低氧、充惰性氣體等,這些方法在一定程度上收到了好的或比較好的效果,但仍存在許多問題。主要問題是付出的代價高,占的空間大,保存時間短,而且易受環境條件的限製。植物組織培養結合超低溫保存技術,可以給植物種質保存帶來一次大的飛躍。因為保存一個細胞就相當與保存一粒種子,但所占的空間僅為原來的幾萬分之一,而且在-193度的液氮中可以長時間保存,不像種子那樣需要年年更新或經常更新。
環境的不斷變化使許多種類的植物面臨着滅絶的危險,而且許多種植物已經滅絶,留給人類的衹是一種遺憾。如何輓救這些植物,還有許許多多的動物,已成為世人關註的問題。實踐證明,通過組織培養的方法可以使一部分瀕危的植物種類得到延續和保存;如果在結合超低溫保存技術,就可以使這些植物得到較為永久性的保存。其實,對大多數普通植物來說,用組織培養的方法保存其種質材料,也具有十分重要的意義。因為,人們現在無法預知哪些植物會面臨滅頂之災,或許今天看似繁茂的植物,明天就可能被沙漠、洪水、大火或戰爭吞沒。 4、通過花藥和花粉培養獲得單倍體植株、縮短育種年限 通過花藥和花粉組織培養可以獲得單倍體植物,大大縮短了育種時間。使新品種的培育過程大大簡化 5、胚胎培養的應用 在遠源雜交中,雜交後形成的胚珠往往在未成熟狀態時,就停止生長,不能形成有生活力的種子,因而雜交不孕,這給遠緣雜交造成極大睏難。十九世紀二十年代末,Laibach用胚培養技術培養亞麻種間雜種胚,第一個獲得了雜種植物,這一成功為在遠緣時剋服雜交不親和的障礙提供了一項有用的技術。
這項技術發展至今,已經相當成熟,可以說多數植物的成熟或未成熟胚通過培養都可獲得成功。幼胚培養已經可使5個細胞大小的極幼齡的胚狀結構培養成植株。但胚珠培養的研究不多,單個胚珠培養尚存在許多問題,需作深化研究。
遠緣雜交中,由於生理上和遺傳上的障礙而不能雜交成功,可采用試管受精加以剋服,即將母本胚珠離體培養,使異種花粉在胚珠上萌發受精,産生的雜種胚在試管中發育成完整植株。
用胚乳培養可獲得三倍體植株,為誘導形成三倍體植物開闢了一條新途徑。三倍體加倍後得到六倍體,可育成多倍體品種。 6、細胞融合 通過原生質體融合,可部分剋服有性雜交不親和性,而獲得體細胞雜種,從而創造新種貨育成優良品種。 7、培養細胞突變體的應用 培養細胞處在不斷分生狀態,它就容易受培養條件和外加壓力(如射綫、化學物質)的影響而産生誘變,從中可以篩選出有用的突變體,從而育成新品種。目前用這種方法已經篩選到抗病、抗????、高蛋白、高産等突變體,有些已經用於生産。 8、用於遺傳學、分子生物學、細胞生物學、組織學、胚胎學、基因工程、生物工程等 要揭開生命活動的秘密,需要多科學、多技術的相互配合,其中植物組織培養技術是不可缺少的,它為遺傳學、分子生物學、細胞生物學、生物工程等提供了一種有效、快速的方法。因為要揭示生命的奧秘,首先要研究單個基因的作用,研究它在細胞內是如何組裝的,如何與其它基因發生聯繫,如何表達和調控等。分離單個基因,對它DNA進行測序,再對其中的某些鹼基實行突變,然後還需要將基因送到受體細胞當中,看表達情況,以確定其功能。接受基因的受體細胞要産生再生植株,就需要通過組織培養的方法才能實現。 9、利用組織培養的材料作為植物生物反應器 中國的中草藥是一份人類寶貴的財富,但很多種中草藥資源匱乏,産量不足,甚至瀕於滅絶。如果能利用組織和細胞培養的方法在實驗室內生産,不再依附於自然環境,不僅可以解决現有睏難,而且可以通過篩選高産有效成分的細胞係,來提高其藥用價值。比如用培養的人參懸浮細胞,來生産人參皂苷,已在日本等國傢形成規模。利用培養的植物細胞和組織細胞作為生物反應器,也可以生産某些蛋白質、氨基酸、抗生素、疫苗等,如用生食蔬菜生産乙肝疫苗正在實驗中。 10、用於其它未知科學的研究 現代科學發展非常迅速,很多現在預想不到的事情都有可能發生,新發明、新發現、新創造層出不窮,今天認為不可能的東西明天就可能變成現實。植物組織培養也同樣具有許多尚未發掘出的潛力,說不定有一天人們會在三角瓶內種出大南瓜。
總之,現在的植物組織培養仍然處於發展階段,遠遠沒有達到它的高峰期,很多機理人們還沒有搞清楚,它的潛力還遠遠沒有發揮出來。相信在今後的幾十年內,組織培養在我國將會有更大的發展,在農業、製藥業、加工業等方面將會發揮更大的作用,創造出更大的經濟效益。 |
組織培養的分類 The classification of tissue culture |
| 按外植體分,植物組織培養可分以下幾類:1、胚胎培養植物的胚胎培養,包括胚培養、胚乳培養、胚珠和子房培養,以及離體受精的胚胎培養技術等。 2、器官和組織培養器官培養是指植物某一器官的全部或部分或器官原基的培養,包括莖段、莖尖、塊莖、球莖、葉片、花序、花瓣、子房、花藥、花托、果實、種子等。組織培養有廣義和狹義之分。廣義:包括各種類型外植體的培養。狹義:包括形成層組織、分生組織、表皮組織、薄壁組織和各種器官組織,以及其培養産生的愈傷組織。 3、細胞培養細胞培養包括利用生物反應器進行的,旨在促進細胞生長和生物合成的大量培養係統和利用單細胞剋隆技術促進細胞生長、分化直至形成完整植株的單細胞培養。 4、原生質體培養植物原生質體是被去掉細胞壁的由質膜包裹的、具有生活力的裸細胞。 |
組織培養的步驟 Tissue culture step |
 组织培养的步骤 组织培养的步骤
配製培養基有兩種方法可以選擇,一是購買培養基中所有化學藥品,按照需要自己配製;二是購買商品的混合好的培養基基本成分粉劑,如MS、B5等。
自己配製可以節約費用,但浪費時間、人力、且有時由於藥品的質量問題,給實驗帶來麻煩。就目前國內的情況看,大部分還是自己配製。為了方便起見,現以MS培養基為例介紹配置培養基的主要過程。
1、配製幾種母液
(1)配製MS大量元素母液
一般將大量元素分別配製成100倍的母液,使用時再分別稀釋100倍。
分別稱取
NH4NO3 165g KH2PO4 17g
KNO3 190g CaCl2·2H2O 44g
MgSO4·7H2O 37g
各自配成1L的母液。倒入1L試劑瓶中,存放於冰箱中。
(2)配製MS微量元素母液
一般將微量元素配製成100倍母液。
依次稱取
KI 0.083g Na2MoO4·2H2O 0.025g
H3BO3 0.62g CuSO4·5H2O 0.0025g
MnSO4·H2O 1.69g CoCl2·6H2O 0.0025g
ZnSO4·7H2O 0.86g
配成1L母液,倒入1L試劑瓶中,存放於冰箱中。
CuSO4·5H2O和CoCl2·6H2O 由於稱取量很小,如果天平精確度沒有達到萬分之一,可先配成調整液。
分別稱取
CuSO4·5H2O 0.05g CoCl2·6H2O 0.05g
各自配成100ml的調整液,然後取5ml就還有0.0025g的量。
(3)配製MS有機母液
一般配製成100倍MS有機母液。
依次稱取
肌醇 10g ????酸硫胺素(VB1) 0.01g
煙酸 0.05g 甘氨酸 0.2g
????酸吡哆醇(VB6) 0.05g
配成1L母液,倒入1L試劑瓶中,存放於冰箱中。
(4)配製MS鐵????母液
一般配製成100倍MS鐵????母液。
依次稱取
EDTA二鈉 3.73g FeSO4·7H2O 2.78g
配成1L母液,倒入1L試劑瓶中,存放於冰箱中。
所以MS母液有5種大量元素母液,加上MS微量元素母液、MS有機母液和MS鐵????母液,共8種母液。
激素母液的配製
各種生長素和細胞分裂素要單獨配製,不能混合在一起,生長素類一般要先用少量95%的酒精或1當量的NaOH溶解,細胞分裂素一般要先用1當量的????酸溶解,然後再加蒸餾水定容。一般取100mg配成100ml母液。
2、配製培養基
以配置1L MS培養基為例,按順序進行如下操作:
(1)先在燒杯中放入一些蒸餾水。
(2)分別取上面八種母液10ml倒入。
(3)一般稱取30g蔗糖倒入,攪拌溶解。
(4)加蒸餾水用量筒定溶至1L。
(5)按設計好的方案添加各種激素,由於激素的用量很小,而且激素對組培植物的生長至關重要。所以有條件的話最好用微量可調移液器吸取,減少誤差。
(6)用精密試紙或酸度計調整PH至5.7-5.8。(有條件的話使用酸度計,比較精確) 可配1當量的HCL和1當量的NaOH用來調溶液PH值。
1當量HCL配製:用量筒量取8.3ml配成100ml溶液。
1當量NaOH配製:稱取NaOH 4g 配成100ml溶液。
(7)稱取5g左右瓊脂粉(質量好的瓊脂粉),倒入上面配好的溶液中,放在電爐上加熱至沸騰,直到瓊脂粉熔化。
(8)稍微冷卻後,分裝入培養容器中。無蓋的培養容器要用封口膜或牛皮紙封口,用橡皮筋或繩子紮緊。
(9)放入消毒滅菌鍋滅菌,滅菌20分鐘左右。
(10)滅菌後從滅菌鍋中取出培養基,平放在實驗臺上令其冷卻凝固。
二、滅菌
滅菌是組織培養重要的工作之一。初學者要清楚有菌和無菌的範疇。有菌的範疇是:凡是暴露在空氣中的物體,接觸自然水源的物體,至少它的表面都是有菌的。依此觀點,無菌室等未處理的地方、超淨臺的表面、簡單煮沸的培養基、我們使用的刀、剪在未處理之前、我們身體的整個外表及與外界相連的內表,如整個消化道、呼吸道,即我們呼出的氣體、培養容器無論洗得多幹淨等等都是有菌的。
這裏所指的菌,包括細菌、真菌、放綫菌、藻類及其他微生物。菌的特點是:極小,肉眼看不見。無處不在,無時不有,無孔不入。在自然條件下忍耐力強,生活條件要求簡單,繁殖力極強,條件適宜時便可大量滋生。
無菌的範疇是:經高溫灼燒或一定時間蒸煮過後的物體,經其他物理或化學的滅菌方法處理後的物體(當然這些方法必須已經證明是有效的),高層大氣、岩石內部、健康的動、植物的不與外部接觸的組織內部,強酸強鹼,化學元素滅菌劑等表面和內部都是無菌的。從以上可以看出:在地球表面無菌世界要比有菌世界小的多。
滅菌是指用物理或化學的方法,殺死物體表面和孔隙內的一切微生物或生物體,即把所有生命的物質全部殺死。與此相關的一個概念是消毒,它指殺死、消除或充分抑製部分微生物,使之不再發生危害作用,顯然經過消毒,許多細菌芽孢、黴菌厚垣孢子等不會完全殺死,即由於在消毒後的環境裏和物品上還有活着的微生物,所以通過嚴格滅菌的操作空間(接種、超淨臺等)和使用的器皿,以及操作者的衣着和手都不帶任何活着的微生物。在這樣的條件下進行的操作,就叫做無菌操作。
植物組織培養對無菌條件的要求是非常嚴格的,甚至超過微生物的培養要求,這是因為培養基含有豐富的營養,稍不小心就引起雜菌污染。要達到徹底滅菌的目的,必須根據不同的對象采取不同的切實有效的方法滅菌,才能保證培養時不受雜菌的影響,使試管苗能正常生長。
常用的滅菌方法可分為物理的和化學的兩類,即:物理方法如幹熱(烘燒和灼燒)、濕熱(常壓或高壓蒸煮)、射綫處理(紫外綫、超聲波、微波)、過濾、清洗和大量無菌水衝洗等措施;化學方法是使用升汞、甲醛、過氧化氫、高錳酸鉀、來蘇水、漂白粉、次氯酸鈉、抗菌素、酒精化學藥品處理。這些方法和藥劑要根據工作中的不同材料不同目的適當選用。
1、培養基用濕熱滅菌
培養基在製備後的24小時內完成滅菌工序。高壓滅菌的原理是:在密閉的蒸鍋內,其中的蒸汽不能外溢,壓力不斷上升,使水的沸點不斷提高,從而鍋內溫度也隨之增加。在0.1MPa的壓力下,鍋內溫度達121℃。在此蒸汽溫度下,可以很快殺死各種細菌及其高度耐熱的芽孢。
註意完全排除鍋內空氣,使鍋內全部是水蒸氣,滅菌才能徹底。高壓滅菌放氣有幾種不同的做法,但目的都是要排淨空氣,使鍋內均勻升溫,保證滅菌徹底。常用方法是:關閉放氣閥,通電後,待壓力上升到0.05MPa時,打開放氣閥,放出空氣,待壓力表指針歸零後,再關閉放氣閥。
關閥再通電後,壓力表上升達到0.1MPa時,開始計時,維持壓力0.1-0.15MPa,20分鐘。
按容器大小不同,保壓時間有所不同,見表。該表所列數字是徹底滅菌很保險的數字,如果容器體積較大,但是放置的數量很少,也可以減少時間。
三、接種
接種時由於有一個敞口的過程,所以是極易引起污染的時期,這一時期主要由空氣中的細菌和工作人員本身引起,接種室要嚴格進行空間消毒。接種室內保持定期用1%-3%的高錳酸鉀溶液對設備、墻壁、地板等進行搽洗。除了使用前用紫外綫和甲醛滅菌外,還可在使用期間用70%的酒精或3%的來蘇兒噴霧,使空氣中灰塵顆粒沉降下來。無菌操作可按以下步驟進行:
(1)在接種4小時前用甲醛熏蒸接種室,並打開其內紫外綫燈進行殺菌;
(2)在接種前20分鐘,打開超淨工作臺的風機以及臺上的紫外綫燈;
(3)接種員先洗淨雙手,在緩衝間換好專用實驗服,並換穿拖鞋等;
(4)上工作臺後,用酒精棉球搽拭雙手,特別是指甲處。然後搽拭工作臺面;
(5)先用酒精棉球搽拭接種工具,再將鑷子和剪刀從頭至尾過火一遍,然後反復過火尖端處,對培養皿要過火烤幹;
(6)接種時,接種員雙手不能離開工作臺,不能說話、走動和咳嗽等;
(7)接種完畢後要清理幹淨工作臺,可用紫外綫燈滅菌30分鐘,若連續接種,每5天要大強度滅菌一次。
接種是將已消毒好的根、莖、葉等離體器官,經切割或剪裁成小段或小塊,放入培養基的過程。現將接種前後的程序連貫地介紹。
無菌接種步驟:
(1)將初步洗滌及切割的材料放入燒杯,帶入超淨臺上,用消毒劑滅菌,再用無菌水衝洗,最後瀝去水分,取出放置在滅過菌的紗布上或濾紙上。
(2)材料吸幹後,一手拿鑷子、一手拿剪刀或解剖刀,對材料進行適當的切割。如葉片切成0.5cm平方的小塊;莖切成含有一個節的小段。微莖尖要剝成衹含1-2片幼葉的莖尖大小等。在接種過程中要經常灼燒接種器械,防止交叉污染。
(3)用灼燒消毒過的器械將切割好的外植體插植或放置到培養基上。具體操作過程(以試管為例)是:先解開包口紙,將試管幾乎水平拿着,使試管口靠近酒精燈火焰,並將管口在火焰上方轉動,使管口裏外灼燒數秒鐘。若用棉塞蓋口,可先在管口外面灼燒,去掉棉塞,再燒管口裏面。然後用鑷子夾取一塊切好的外植體送入試管內,輕輕插入培養基上。若是葉片直接附在培養基上,以放1-3塊為宜。至於材料放置方法除莖尖、莖段要正放(尖端嚮上)外,其他尚無統一要求。接種完後,將管口在火焰上再灼燒數秒種。並用棉塞,塞好後,包上包口紙,包口紙裏面也要過火。
四、培養
培養指把培養材料放在培養室(有光照、溫度條件)裏,使之生長,分裂和分化形成愈傷組織或進一步分化成再生植株的過程。
1、培養方法
(1)固體培養法
即用瓊脂固化培養基來培養植物材料的方法。是現在最常用的方法。雖然該方法設備簡單,易行,但養分分佈不均,生長速度不均衡,並常有褐化中毒現象發生。
(2)液體培養法
即用不加固化劑的液體培養基培養植物材料的方法。由於液體中氧氣含量較少,所以通常需要通過攪動或振動培養液的方法以確保氧氣的供給,采用往復式搖床或旋轉式搖床進行培養,其速度一般為50-100r/min,這種定期浸沒的方法,既能使培養基均一,又能保證氧氣的供給。
2、培養步驟
(1)初代培養
初代培養旨在獲得無菌材料和無性繁殖係。即接種某些外植體後,最初的幾代培養。初代培養時,常用誘導或分化培養基,即培養基中含有較多的細胞分裂素和少量的生長素。初代培養建立的無性繁殖係包括:莖梢、芽叢、胚狀體和原球莖等。根據初代培養時發育的方向可分為:
1)頂芽和腋芽的發育
采用外源的細胞分裂素,可促進使具有頂芽或沒有腋芽的休眠側芽啓動生長,從而形成一個微型的多枝多芽的小灌木叢狀的結構。在幾個月內可以將這種叢生苗的一個枝條轉接繼代,重複芽苗增殖的培養,並且迅速獲得多數的嫩莖。然後將一部分嫩莖轉移到生根培養基上,就能得到可種植到土壤中去的完整小植株。一些木本植物和少數草本植物也可以通過這種方式來進行再生繁殖,如月季、茶花、菊花、香石竹等等。這種繁殖方式也稱作微型繁殖,它不經過發生愈傷組織而再生,所以是最能使無性係後代保持原品種的一種繁殖方式。
適宜這種再生繁殖的植物,在采樣時,衹能采用頂芽、側芽或帶有芽的莖切段,其他如種子萌發後取枝條也可以。
莖尖培養可看作是這方面較為特殊的一種方式。它采用極其幼嫩的頂芽的莖尖分生組織作為外植體進行接種。在實際操作中,采用包括莖尖分生組織在內的一些組織來培養,這樣便保證了操作方便以及容易成活。
用靠培養定芽得到的培養物一般是莖節較長,有直立嚮上的莖梢,擴繁時主要用切割莖段法,如香石竹、矮牽牛、菊花等。但特殊情況下也會生出不定芽,形成芽叢。
2)不定芽的發育
在培養中由外植體産生不定芽,通常首先要經脫分化過程,形成愈傷組織的細胞。然後,經再分化,即由這些分生組織形成器官原基,它在構成器官的縱軸上表現出單嚮的極性(這與胚狀體不同)。多數情況下它形成芽,後形成根。
另一種方式是從器官中直接産生不定芽,有些植物具有從各個器官上長出不定芽的能力如矮牽牛、福祿考、懸鈎子等。當在試管培養的條件下,培養基中提供了營養,特別是提供了連續不斷植物激素的供應,使植物形成不定芽的能力被大大地激發起來。許多種類的外植體表面幾乎全部為不定芽所覆蓋。在許多常規方法中不能無性繁殖的種類,在試管條件下卻能較容易地産生不定芽而再生,如柏科,鬆科,銀杏等一些植物。許多單子葉植物儲藏器官能強烈地發生不定芽,用百合鱗片的切塊就可大量形成不定鱗莖。
在不定芽培養時,也常用誘導或分化培養基。用靠培養不定芽得到的培養物,一般采用芽叢進行繁殖,如非洲菊、草莓等。
3)體細胞胚狀體的發生與發育
體細胞胚狀體類似於合子胚但又有所不同,它也通過球形,心形,魚雷形和子葉形的胚胎發育時期,最終發育成小苗。但它是由體細胞發生的。胚狀體可以從愈傷組織表面産生,也可從外植體表面已分化的細胞中産生,或從懸浮培養的細胞中産生。
4)初代培養外植體的褐變
外植體褐變是指在接種後,其表面開始褐變,有時甚至會使整個培養基褐變的現象。它的出現是由於植物組織中的多酚氧化酶被激活,而使細胞的代謝發生變化所致。在褐變過程中,會産生醌類物質,它們多呈棕褐色,當擴散到培養基後,就會抑製其他酶的活性,從而影響所接觸外植體的培養。
褐變的主要原因如下:
a、植物品種 研究表明,在不同品種間的褐變現象是不同的。由於多酚氧化酶活性上的差異,因此,有些花卉品種的外植體在接種後較容易褐變,而有些花卉品種的外植體在接種後不容易褐變。因此,在培養過程中應該有所選擇,對不同的品種分別進行處理。
b、生理狀態由於外植體的生理狀態不同,所以在接種後褐變程度也有所不同。一般說來,處於幼齡期的植物材料褐變程度較淺,而從已經成年的植株采收的外植體,由於含醌類物質較多,因此褐變較為嚴重。一般來說,幼嫩的組織在接種後褐變程度並不明顯,而老熟的組織在接種後褐變程度較為嚴重。
c、培養基成分 濃度過高的無機????會使某些觀賞植物的褐變程度增加,此外,細胞分裂素的水平過高也會刺激某些外植體的多酚氧化酶的活性,從而使褐變現象加深。
d、培養條件不當 如果光照過強、溫度過高、培養時間過長等,均可使多酚氧化酶的活性提高,從而加速被培養的外植體的褐變程度。
為了提高組織培養的成苗率,必須對外植體的褐變現象加以控製。可以采用以下措施防止、減輕褐變現象的發生。
1、選擇合適的外植體 一般來說,最好選擇生長處於旺盛的外植體,這樣可以使褐變現象明顯減輕。
2、合適的培養條件 無機????成分、植物生長物質水平、適宜溫度、及時繼代培養均可以減輕材料的褐變現象。
3、使用抗氧化劑 在培養基中,使用半胱氨酸、抗壞血酸等抗氧化劑能夠較為有效地避免或減輕很多外植體的褐變現象。另外,使用0.1%-0.5%的活性炭對防止褐變也有較為明顯的效果。
4、連續轉移 對容易褐變的材料可間隔2-24小時的培養後,再轉移到新的培養基上,這樣經過連續處理7-10天後,褐變現象便會得到控製或大為減輕。
(2)繼代培養
在初代培養的基礎上所獲得的芽、苗、胚狀體和原球莖等,數量都還不夠,它們需要進一步增殖,使之越來越多,從而發揮快速繁殖的優勢。
繼代培養是繼初代培養之後的連續數代的擴繁殖培養過程。旨在繁殖出相當數量的無根苗,最後能達到邊繁殖邊生根的目的。繼代培養的後代是按幾何級數增加的過程。如果以2株苗為基礎,那麽經10代將生成210株苗。
繼代培養中擴繁的方法包括:切割莖段、分離芽叢、分離胚狀體、分離原球莖等。切割莖段常用於有伸長的莖梢、莖節較明顯的培養物。這種方法簡便易行,能保持母種特性。培養基常是MS基本培養基;分離芽叢適於由愈傷組織生出的芽叢。培養基常是分化培養基。若芽叢的芽較小。可先切成芽叢小塊,放入MS培養基中,待到稍大時,再分離開來繼續培養。
增殖使用的培養基對於一種植物來說每次幾乎完全相同,由於培養物在接近最良好的環境條件,營養供應和激素調控下,排除了其他生物的競爭,所以能夠按幾何級數增殖。
在快速繁殖中初代培養衹是一個必經的過程,而繼代培養則是經常性不停的進行過程。但在達到相當數量之後,則應考慮使其中一部分轉入生根階段。從某種意義上講,增殖衹是儲備母株,而生根纔是增殖材料的分流,生産出成品。
(3)繼代培養時材料的玻璃化
實踐表明,當植物材料不斷地進行離體繁殖時,有些培養物的嫩莖、葉片往往會呈半透明水跡狀,這種想象通常稱為玻璃化。它的出現會使試管苗生長緩慢、繁殖係數有所下降。玻璃化為試管苗的生理失調癥。
因為出現玻璃化的嫩莖不宜誘導生根,因此,使繁殖係數大為降低。在不同的種類、品種間,試管苗的玻璃化程度也有所差異。當培養基上細胞分裂素水平較高時,也容易出現玻璃化現象。在培養基中添加少量聚乙烯醇、脫落酸等物質,能夠在一定程度上減輕玻璃化的現象發生。
呈現玻璃化的試管苗,其莖、葉表面無蠟質,體內的極性化合物水平較高,細胞持水力差,植株蒸騰作用強,無法進行正常移栽。這種情況主要是由於培養容器中空氣濕度過高,透氣性較差造成的,其具體解决的方法為:
a、增加培養基中的 溶質水平,以降低培養基的水勢;
b、減少培養基中含氮化合物的用量;
c、增加光照
d、增加容器通風,最好進行CO2施肥,這對減輕試管苗玻璃化的現象有明顯的作用;
e、降低培養溫度,進行變溫培養,有助於減輕試管苗玻璃化現象發生;
f、降低培養基中細胞分裂素含量,可以考慮加入適量脫落酸。
3、生根培養
當材料增殖到一定數量後,就要使部分培養物分流到生根培養階段。若不能及時將培養物轉到生根培養基上去,就會使久不轉移的苗子發黃老化,或因過分擁擠而使無效苗增多造成拋棄浪費。根培養是使無根苗生根的過程,這個過程目的是使生出的不定根濃密而粗壯。生根培養可采用1/2或者1/4MS培養基,全部去掉細胞分裂素,並加入食糧非的生長素(NAA、IBA等)。
誘導生根可以采用下列方法
a、將新梢基部浸入50或100*10-6IBA溶液中處理4-8小時;
b、在含有生長素的培養基中培養4-6天
c、直接移入含有生長素的生根培養基中。
上述三種方法均能誘導新梢生根,但前兩種方法對新生根的生長發育則更為有利。而第三種對幼根的生長有抑製作用。其原因是當根原始體形成後較高濃度生長素的繼續存在,則不利於幼根的生長發育。不過這種方法比較可行。
另外也可采用下列方法就可生根。1、延長在增殖培養基中的培養時間;2、有意降低一些增殖倍率,減少細胞分裂素的用量(即將增殖與生根合併為一步);3、切割粗壯的嫩枝在營養鉢中直接生根,此方法則沒有生根階段。可以省去一次培養基製作,切割下的插穗可用生長素溶液浸蘸處理,但這種方法衹適於一些容易生根的作物。
另外少數植物生根比較睏難時,則需要在培養基中放置濾紙橋,使其略高於液面,靠濾紙的吸水性供應水和營養,從而誘發生根。
從胚狀體發育成的小苗,常常有原先已分化的根,這種根可以不經誘導生根階段而生長。但因經胚狀體發育的苗數特別多,並且個體較小,所以也常需要一個低濃度或沒有植物激素的培養基培養的階段,以便壯苗生根。
試管內生根壯苗的階段,為了成功地將移植到試管外的環境中,以使試管苗適應外界的環境條件。通常不同植物的適宜馴化溫度不同。如菊花,以18-20℃為宜。實踐證明植物生長的溫度過高不但會牽涉到蒸騰加強。而且還牽涉到菌類易滋生的問題。溫度過低使幼苗生長遲緩,或不易成活。春季低溫時苗床可加設電熱綫,使基質溫度略高於氣溫2-3℃,這不但有利於生根和促進根係發達,而且有利於提前成活。
移植到試管外的植物苗光強度應比移植前培養有所提高,並可適應強度較高的漫射光,(約4000lx左右),以維持光合作用所需光照強度。但光綫過強刺激蒸騰加強,會使水分平衡的矛盾更尖銳。
五、馴化移栽
試管苗移栽是組織培養過程的重要環節,這個工作環節做不好,就會造成前功盡弃。為了做好試管苗的移栽,應該選擇合適的基質,並配合以相應的管理措施,才能確保整個組織培養工作的順利完成。
試管苗由於是在無菌、有營養供給、適宜光照和溫度近100%的相對濕度環境條件下生長的,因此,在生理、形態等方面都與自然條件生長的小苗有着很大的差異。所以必須通過煉苗,例如通過控水、減肥、增光、降溫等措施,使她們逐漸地適應外界環境,從而使生理、形態、組織上發生相應的變化,使之更適合於自然環境,衹有這樣才能保證試管苗順利移栽成功。
從葉片上看,試管苗的角質層不發達,葉片通常沒有表皮毛,或僅有較少表皮毛,甚至葉片上出現了大量的水孔,而且,氣孔的數量、大小也往往超過普通苗。由此可知,試管苗更適合於高濕的環境生長,當將它們移栽到試管外環境時,試管苗失水率會很高,非常容易死亡。因此,為了改善試管苗的上述不良生理、形態特點,則必須經過與外界相適應的馴化處理,通常采取的措施有:對外界要增加濕度、減弱光照;對試管內要通透氣體、增施二氧化碳肥料、逐步降低空氣濕度等。
另外,對栽培馴化基質要進行滅菌是因為試管苗在無菌的環境中生長,對外界細菌、真菌的抵禦能力極差。為了提高其成活率,在培養基質中可摻入75%的百菌清可濕性粉劑200-500倍液,以進行滅菌處理。
1、移栽用基質和容器
適合於栽種試管苗的基質要具備透氣性、保濕性和一定的肥力,容易滅菌處理,並不利於雜菌滋生的特點,一般可選用珍珠岩、蛭石、砂子等。為了增加粘着力和一定的肥力可配合草炭土或腐殖土。配時需按比例搭配,一般用珍珠岩、蛭石、草炭土或腐殖土比例為1:1:0.5。也可用砂子:草炭土或腐殖土為1:1。這些介質在使用前應高壓滅菌。或用至少小時烘烤來消滅其中的微生物。要根據不同植物的栽培習性來進行配製,這樣才能獲得滿意的栽培效果。以下介紹幾種常見的試管苗栽培基質。
(1)河砂
河砂分為粗砂、細砂兩種類型。粗砂即平常所說的河砂,其顆粒直徑為1-2mm。細砂即通常所說的面砂,其顆粒直徑為0.1-0.2nm。河砂的特點是排水性強,但保水蓄肥能力較差,一般不單獨用來直接栽種試管苗。
(2)草炭土
草炭土是由沉積在沼澤中的植物殘骸經過長時間的腐爛所形成,其保水性好,蓄肥能力強,呈中性或微酸性反應,但通常不能單獨用來栽種試管苗,宜與河砂等種類相互混合配成盆土而加以使用。
(3)腐殖土
腐殖土是由植物落葉經腐爛所形成。一種是自然形成,一種是人為造成,人工製造時可將秋季的落葉收集起來,然後埋入坑中,灌水保濕的條件下使其風化,然後過篩即可獲得。腐葉上含有大量的礦質營養、有機物質,它通常不能單獨使用。摻有腐殖土的栽培基質有助於植株發根。
(4)容器
栽培容器可用6*6cm-10*10cm的軟塑料鉢,也可用育苗盤。前者占地大,耗用大量基質,但幼苗不用移栽,後者需要二次移苗,但省空間、省基質。
2、移栽前的準備
移栽前可將培養物不開口移到自然光照下鍛煉2-3天,讓試管苗接受強光的照射,使其長得壯實起來,然後再開口練苗1-2天,經受較低濕度的處理,以適應將來自然濕度的條件。
3、移栽和幼苗的管理
從試管中取出發根的小苗,用自來水洗掉根部粘着的培養基,要全部除去,以防殘留培養基滋生雜菌。但要輕輕除去,應避免造成傷根。移植時用一個筷子粗的竹簽在基質中插一小孔,然後將小苗插入,註意幼苗較嫩,防止弄傷,栽後把苗周圍基質壓實,栽前基質要澆透水。栽後輕澆薄水。再將苗移入高濕度的環境中。保證空氣濕度達90%以上。
(1)保持小苗的水分供需平衡。在移栽後5-7天內,應給予較高的空氣濕度條件,使葉面的水分蒸發減少,盡量接近培養瓶的條件,讓小苗始終保持挺拔的狀態。保持小苗水分供需平衡首先營養鉢的培養基質要澆透水,所放置的床面也要澆濕,然後搭設小拱棚,以減少水分的餓蒸發,並且初期要常噴霧處理,保持拱棚薄膜上有水珠出現。當5-7天後,發現小苗有生長趨勢,可逐漸降低濕度,減少噴水次數,將拱棚兩端打開通風,使小苗適應濕度較小的條件。約15天以後揭去拱棚的薄膜,並給予水分控製,逐漸減少澆水,促進小苗長得粗壯。
(2)防止菌類滋生。由於試管苗原來的環境是無菌的,移出來以後難以保持完全無菌,因此,應盡量不使菌類大量滋生,以利成活。所以應對基質進行高壓滅菌或鴻烤滅菌。可以適當使用一定濃度的殺菌劑以便有效的保護幼苗,如多菌靈、托布津,濃度800-1000倍,噴藥宜7-10天一次。在移苗時盡量少傷苗,傷口過多,根損傷過多,都是造成死苗的原因。噴水時可加入0.1%的尿素,或用1/2MS大量元素的水溶液作追肥,可加快苗的生長與成活。
(3)一定的溫、光條件。 試管苗移栽以後要保持一定的溫光條件,適宜的生根溫度是18-20℃,鼕春季地溫較低時,可用電熱綫來加溫。溫度過低會使幼苗生長遲緩,或不易成活。溫度過高會使水分蒸發,從而使水分平衡受到破壞,並會促使菌類滋生。
另外在光照管理的初期可用較弱的光照,如在小拱棚上加蓋遮陽網或報紙等,以防陽光灼傷小苗和增加水分的蒸發。當小植株有了新的生長時,逐漸加強光照,後期可直接利用自然光照。促進光合産物的積纍,增強抗性,促其成活。
(4)保持基質適當的通氣性。 要選擇適當的顆粒狀基質,保證良好的通氣作用。在管理過程中不要澆水過多,過多的水應迅速瀝除,以利根係呼吸。
綜上所述,試管苗在移栽的過程中,衹要把水分平衡、適宜的介質、控製雜菌和適宜的光、溫條件控製好,試管苗是很容易移栽的。 |
|
組織培養
tissue culture
人工培養活組織的方法。組織培養需在無菌條件下,將活組織移植在含有營養成分的培養基(常用血清和胚胎提取液製成)內,並放在適當溫度的溫箱中。通過培養以觀察細胞和組織生長、繁殖和分化情況。在培養過程中,如給予各種能夠引起組織變化的條件,則可以追查組織發生變化的過程和原因。各種組織細胞培養也可以作為培養和鑒定病毒的工具。
|
|
- n.: tissue culture
|
|
| 培養基 | 生物化學 | 生物學 | 自然科學 | 植物激素 | 生命科學 | 生物 | 組培 | | 植物組織培養 | 蘭花 | 胚狀體 | 莖尖培養 | 愈傷組織 | 細胞工程 | 微繁 | |
|
|
| 組織培養箱 | 組織培養術 | | 組織培養油 | 無菌組織培養 | | 愈傷組織培養 | 植物組織培養 | | 組織培養技術 | 花卉組織培養 | | 離體組織培養 | 分生組織培養 | | 組織培養顯微鏡 | 細胞與組織培養 | | 藥用植物組織培養 | 植物組織培養中心 | | 組織培養感染劑量 | 植物組織培養方法 | | 頂端分生組織培養 | 觀賞植物組織培養技術 | | 藥用植物組織培養和快速繁殖 | 現代育苗技術叢書林果花菜組織培養快速育苗技術 | |
|